- 上一篇:增环香豆素类化合物的新法合成
- 下一篇:微波辐射下7-苯基取代吡唑并[3,4-b]吡咯并[4,3,2-de]喹啉衍生物的合成
Chen课题组成功合成了一系列二硫键核交联的基于聚乙二醇-聚氨基酸星型共聚物的抗癌药物载体[11](图1)。首先他们通过相应的氨基酸合成还原敏感的L-胱氨酸N-羧酸酐(L-Cys NCA)和L-苯丙氨酸N-羧酸酐(L-Phe NCA)小分子单体,然后以PEG-NH2来开环共聚得到具有良好生物相容性的星型共聚物,用于制备还原响应性纳米载体。Zhang等人报道了具有还原响应性壳交联的聚氨基酸-b-葡聚糖(PBLG-b-dextran)胶束,用于包裹抗癌药物及细胞内药物释放[12]。他们以具有良好生物相容性和生物可降解性的聚谷氨酸苄酯作为疏水链段,通过Click反应与亲水链段的葡聚糖连接起来,用于包裹阿霉素(DOX)。形成的胶束载体将药物安全地输送到细胞内,在细胞内还原环境触发下,从PBLG疏水性核中释放出药物,同时具有良好的生物可降解性的PBLG也能够促进药物的完全释放。
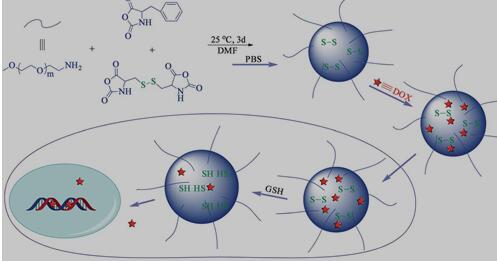
图1. 聚氨基酸纳米胶束的制备,对DOX的装载以及GSH触发释放
聚磷酸酯是一类新型生物可降解材料,它在生物医药领域受到越来越广泛的关注[13]。这是由于聚磷酸酯结构中不管是主链还是侧链都可以有很多变化,尤其是侧链上可以引入一系列基团从而得到各种功能化的聚磷酸酯材料。同时聚磷酸酯生物相容性好,生物可降解能力强,具有较强的细胞亲和力。正是由于聚磷酸酯的这些显著优势使其广泛应用于生物材料领域,如疏水性聚磷酸酯能够包裹疏水性药物;亲水性聚磷酸酯可以作为基因的新型良好载体;两亲性聚磷酸酯聚合物本身便可以自组装形成胶束、囊泡等药物载体,用于药物传递系统[14-16]。
Wang课题组以聚乙二醇和功能化聚磷酸酯设计合成出双重pH敏感的聚合物-药物偶联物(PPC-Hyd-DOX-DA)。而由于聚磷酸酯结构多变,易官能化修饰,他们在聚磷酸酯侧链通过巯基-烯点击反应引入氨基,然后通过腙键偶联上阿霉素以及酰胺键引入2,3-二甲基马来酸。这使得构建出的纳米粒子系统在pH 7.4时带有表面负电荷,当纳米粒子系统在血液循环中积累到肿瘤组织(pH 6.8)时,酸响应性的酰胺键断裂,这样就使纳米粒子的表面带有正电荷,极大地促进了肿瘤细胞对纳米粒子的内吞。在内涵体和溶酶体(pH 5.0)中,酸不稳定的腙键断裂而释放出DOX。这种双重pH敏感的纳米粒子系统增强了对SK-3rd肿瘤干细胞的耐药性的抑制作用[17](图2)。
双重pH响应性的PPC-Hyd-DOX-DA聚合物-DOX偶联物胶束的细胞内化和细胞内药物释放过程示意图
还原响应性嵌段共聚物具有高效快速释放药物、可生物降解、毒副作用小等优点并逐渐成为药物载体领域的研究热点。近年来,研究者们还设计合成了一些主链含有二硫键的两亲性嵌段聚合物,并通过自组装形成相应的胶束,研究了其对药物的包载与释放及细胞层面的行为。
Chen课题组报道了一种基于二硫键连接的聚乙二醇-聚赖氨酸苄酯嵌段共聚物的还原响应型胶束系统,用于细胞内药物输送[18](图3)。它具有优良的血液相容性和细胞、组织相容性,在药物输送方面有着巨大的应用潜力。通过纳米沉淀法将30 wt.%的抗癌药物阿霉素(DOX)装载进胶束。形成的载药胶束在10 mM GSH(模拟细胞内还原环境)存在下,主链上亲水段和疏水段之间的二硫键被还原而断裂,导致胶束被破坏,使得载药胶束能够释放出90%以上的DOX。CLSM观察发现该还原响应性载药胶束与10 mM GSH-OEt预处理的HeLa细胞孵育2 h后便可以在细胞核中发现DOX荧光,表明DOX已经快速释放到细胞核中。相应地,其MTT实验显示该载DOX还原敏感的胶束在与HeLa和HepG2细胞分别孵育72 h后,均表现出良好的细胞抑制能力,其中效果最好的mPEG113-SS-PZLL35载药胶束的IC50分别为0.24和1.25 mgDOX/L。